自2000年起,大環內酯類耐藥Mp在全球各地流行的證據越來越多[6],對臨床抗菌治療造成一定的影響。中國、日本等國家報道的部分地區Mp耐藥率已達到90%~100%[7]。重癥Mp肺炎治療挑戰性大,需要早診斷、早治療,實驗室病原學診斷是Mp感染診斷的關鍵。由于Mp的特殊病原學特征,實驗室檢測方法多樣,為規范兒童Mp呼吸道感染實驗室診斷程序,提高診斷效率,經中華醫學會兒科學會臨床檢驗學組專家討論,達成并制訂兒童Mp呼吸道感染實驗室診斷專家共識。
Mp屬于柔膜體綱,支原體屬,是能夠進行自我復制的、有能力在體外不依靠活體細胞而生存的最小微生物[1]。Mp直徑125~150 nm,長約1~2 μm,無細胞壁,僅有細胞膜,革蘭染色陰性。因無細胞壁,Mp呈多形性,其細胞體積小于典型細菌體積的5%,能夠通過0.45 μm孔徑的細菌濾器,在營養豐富的固體培養基(如SP4培養基)上生長,顯微鏡下能夠看到Mp的典型菌落。Mp的基因組長度約800 000 bp[8],包含大約700個蛋白編碼基因和一些非編碼DNA序列。核糖體由30S和50S亞基組成,其基因組為環狀雙股DNA,分子量約5×108[9]。Mp較小的基因組長度以及有限的生物合成能力限制了其生物合成和代謝能力,需要復雜的培養基添加成分才能在體外進行分離培養[10]。Mp生長緩慢,以二分裂方式繁殖,每6 h進行一次分裂,有時需要經過長達數周的生長和(或)多次傳代才能獲得陽性菌株。
Mp的檢測方法主要分病原學檢測和血清學檢測兩大類,需掌握不同檢測方法的特點,依據不同需求和目的選擇不同方法。

一、病原學檢測
(一)培養法
獲取合格的呼吸道標本,用特殊的液體培養基進行3~7 d培養,培養基變色后轉入固體培養基繼續培養至鏡下見到Mp典型菌落或經基因、生化鑒定后判斷為Mp陽性。Mp菌株生長緩慢,需要經過多次傳代培養才出現陽性反應,敏感度為34.78%,Mp培養陽性的診斷特異度接近100%[11],并能對分離株進行種屬鑒定、分型及藥敏實驗,具有重要的臨床意義。Mp專用培養基中必須含有葡萄糖作為代謝底物,同時還應包括血清(作為膽固醇來源)、酵母提取物以及pH顯色劑。推薦使用SP4肉湯及瓊脂培養基進行傳統法Mp培養。
目前有基于培養方法的快速檢測試劑盒,其方法原理是Mp利用試劑中的高營養和快速生長因子迅速增殖,產酸使試劑pH值降低,通過指示劑顏色變化來判斷Mp的存在,或進行藥敏分析。快速培養Mp出現陽性結果的時間較短,6~90 h不等,與Mp生長傳代時間不符。有學者質疑這種快速培養法的特異性,認為導致培養基快速出現陽性變色的原因是其他微生物污染而出現的假陽性。如:患者帶菌或在標本采集、運輸、接種等過程出現細菌或真菌污染,而培養基中相應抗菌素用量不足或含量不均勻也是導致細菌污染發生的因素。另外,口腔酸堿度的影響,如食物殘渣、酸性飲料等,培養操作過程中使用的材料、環境的酸堿度均能改變培養基的顏色。對臨床高度懷疑Mp感染患兒的標本,72 h培養陰性者建議繼續觀察至7 d[12],快速培養陽性應采用分子生物學方法進行病原學診斷確證。
(二)肺炎支原體的直接檢測
采用免疫雙抗夾心的方法[13],取患者呼吸道拭子或吸取物,采用熒光、量子點、膠體金等標記的鼠抗人Mp單克隆抗體,異硫氰酸熒光素或顯色物標記的羊抗鼠抗體IgG來檢測Mp抗原,在熒光顯微鏡下觀察被特異性熒光標記的Mp活躍性或肉眼看到顏色條帶來判斷是否感染。目前多利用高特異性地識別Mp的黏附相關P1蛋白單克隆抗體直接檢測Mp抗原,有報道特異度和敏感度為100%和97.4%[13]。此類方法方便快捷,但易受人為因素干擾,如未取到感染細胞、沒有選中合適的視野或其他病原及自身的交叉抗體干擾等,均會影響結果。
(三)分子生物學
分子生物學檢測主要有DNA和RNA檢測兩大類。該類方法具有高特異性、檢測速度快、樣本周轉時間短的優點,為臨床診治提供明確依據。
1.DNA檢測技術:
基于DNA檢測技術的方法眾多,主要有熒光定量PCR和環介導等溫擴增(loop-mediated isothermal amplification,LAMP)兩種,其檢測樣本為痰、鼻咽拭子、支氣管肺泡灌洗液,檢測靶標為Mp-DNA,根據P1蛋白、16S rRNA等目標基因設計擴增引物。以DNA為靶標的檢測技術靈敏度和特異性都能滿足臨床需求。但是Mp死亡后其DNA仍可存在于部分患者體內,時間達7周~7個月,且不易降解,導致DNA檢驗結果不能很好地用于治療效果的評估。
2.RNA檢測技術:
RNA檢測技術是基于核酸恒溫擴增技術和實時熒光檢測技術相結合的一種核酸檢測方法,簡稱實時熒光恒溫擴增技術(simultaneous amplification and testing,SAT)。其采用的靶標為16S rRNA,在Mp中以多拷貝形式存在(多達104拷貝量),其靈敏度和準確性與DNA檢測方法相比都有很大提高[14]。由于RNA隨病原體死亡而降解,可作為評價Mp感染轉歸、藥物療效的指標,其檢測結果與Mp的感染嚴重程度相關性較好,因此Mp的RNA檢測是目前早期快速診斷、判斷療效的最好方法之一[15]。
對于上述病原學檢測的方法,均需檢測人員嚴格掌握檢驗前質量,尤其是標本采集、運輸、保存、接種、培養方法及操作過程的規范,以期獲得最準確檢測結果。

二、血清學檢測
通常情況下,人體感染Mp后能產生IgM、IgA、IgG類抗體。IgM抗體一般在初次感染1周內開始升高,2~3周達到高峰,4周時下降,2~3月降至最低[16]。IgA抗體在Mp感染早期迅速上升,由IgM型轉換產生,7~14 d至峰值水平,回落比IgM或IgG更早。IgA抗體變化與IgM一致,成人Mp感染IgA陽性率高,與IgM檢測相比,兒童IgA檢出率較低[17,18]。IgG較IgM和IgA出現晚,一般于感染后14 d左右出現,濃度峰值一般在感染后的第5周,具有較長的維持時間[20]。
與病原學檢測方法比較,抗體產生有時間窗和個體差異,但抗體檢測結果不受抗生素治療的影響。臨床上Mp血清學診斷常用方法有酶聯免疫吸附試驗(enzyme-linked immunosorbent assay,ELISA)、顆粒凝集法(particle agglutination,PA)、免疫膠體金技術(immune colloidal gold technique,GICT)、化學發光法(chemiluminescent immunoassay,CLIA)、間接免疫熒光試驗(indirect immunofluorescence assay,IFA)。用于抗體檢測試劑的Mp抗原選擇非常重要,它決定了檢測的敏感度和特異度。目前主要有4大類抗原,Mp全細胞裂解物(全菌體抗原)、蛋白提取物、膜制備物、糖脂提取物。Mp全菌體抗原包括細胞膜的糖脂、蛋白質等成分,特異度和敏感度較差,與人體多種組織細胞膜、某些細菌(如流感嗜血桿菌、奈瑟腦膜炎球菌等)以及其他支原體都會出現非特異性交叉反應;黏附相關蛋白,如P1蛋白、P30蛋白、P116蛋白、重組AtpD蛋白、重組P1-C蛋白等是重要的免疫原,尤其P1蛋白,能刺激機體產生較強烈的免疫應答,是Mp診斷的重要抗原,重組P1蛋白的特異度和敏感度可以達到97.7%和85.0%[16]。
下面介紹各類血清學檢測方法的特點。
(一)ELISA
ELISA作為實驗室常用的雙抗體夾心法,利用其基本原理檢測人血清中Mp的IgM、IgG、IgA各類型抗體,具有較高的敏感度和特異度,其包被的Mp抗原來源多樣,建議選擇敏感度和特異度均較高的抗原包被試劑盒檢測。
(二)PA
PA的原理是將Mp細胞膜(可溶性抗原)致敏或吸附在一定大小的顆粒狀載體的表面,與人血清中存在的Mp抗體結合后,在有電介質存在的適宜條件下,可發生凝集,稱為間接凝集反應。目前常用作載體的顆粒或微球多為人工合成或天然高分子材料制成的,如明膠顆粒、聚苯乙烯膠乳微球等。由于載體顆粒增大了可溶性抗原的反應面積,當顆粒上的抗原與微量抗體結合后,產生肉眼可見的凝集反應。該方法檢測有效性的指標是試劑盒內提供的陽性對照滴度達到1∶320,抗體滴度檢測范圍為1∶40~1∶10 240。患者血清Mp抗體滴度≥1∶160作為Mp近期或急性感染的診斷標準;恢復期和急性期Mp抗體滴度呈4倍及以上增高或減低時,可確診Mp感染[18,20]。PA檢測Mp總抗體,方法重復性好,特異度、敏感度佳,治療前后雙份血清滴度的變化更有利于診斷。
(三)GICT
GICT是一種以新型的免疫標記——膠體金作為示蹤標志物,應用抗原抗體特異性結合的免疫反應原理檢測Mp抗體,主要有免疫層析法和免疫滲濾法。基本原理是反應板上的Mp抗原可與待測樣本中Mp抗體結合,再與膠體金標記的抗人IgM抗體結合并顯色,形成肉眼可見的紅色斑點或條帶判斷陽性。GICT檢測Mp的IgM抗體,研究顯示兒童MP-IgM陽性與PA滴度1∶160和≥1∶320的符合率均為95%;單次測定Mp-IgM陽性對診斷兒童Mp近期感染有價值,適合門診的快速檢測[21]。目前是定性試驗,患者抗體含量較低時可能造成漏檢,且抗體在部分治愈患者體內持續存在,使得對短期內再次感染的陽性判斷造成困擾。
(四)CLIA
CLIA的原理是將發光物質直接標記在Mp抗原上,或免疫復合物上的酶作用于發光底物,通過大型發光儀測量光量子產額,定量、成批地檢測Mp的IgM、IgG,目前此方法的應用、與常用抗體檢測方法的比對研究較少,需進一步積累數據。
(五)IFA
IFA的原理是用標本血清和已知的Mp抗原相互作用,經溫育后洗滌。若待檢測標本中含有相應抗體,則與Mp抗原發生特異性結合且不會被洗掉,與標記有熒光素的抗球蛋白抗體結合,在顯微鏡下觀察綠色熒光。該方法主要檢測Mp IgM抗體,特異度和敏感度較好,具有對照明顯、結果判讀和操作簡單等優點[16]。但該實驗易受人為判斷熒光結果影響,包被抗原含量不足可能會產生假陰性,體內含有類風濕因子、多種自身免疫性抗體等與包被抗原有交叉反應可能出現假陽性。
(六)補體結合試驗(complement fixation assay,CFA)
CFA的原理是利用Mp抗原抗體反應消耗補體從而使補體參與指示系統的抗原抗體反應的濃度降低或消失。CFA檢測抗Mp的總抗體,一般認為滴度>1∶64或恢復期血清呈4倍以上升高有診斷意義。與其他檢測方法相比,CFA采用糖脂抗原,特異性較差,操作過程中存在較多干擾,目前已經很少用于Mp臨床診斷。
(七)冷凝集試驗(cold agalutination test,CAT)
多年前CAT應用于Mp感染的實驗室診斷,血清冷凝集素在感染1周開始升高,4周達高峰,第6周下降或者消失,紅細胞CAT陽性,效價大于1∶32,恢復期效價增加4倍有診斷意義。但冷凝集素增高也可見于其他疾病,如流行性感冒、傳染性單核細胞增多癥、風疹等,故CAT的特異性差,現已逐漸被其他Mp的檢測方法取代。
(八)實驗室Mp血清學檢測結果的判讀
1.顆粒凝集試驗抗體滴度≥1∶160:
提示近期或現癥感染。
2.只有IgM抗體(+):
提示近期感染。
3.只有IgM及IgA(+):
提示現癥感染。
4.只有IgG抗體(+):
提示既往感染。
5.IgM、IgG及lgA均為(+)/IgM及IgG(+)/lgA及lgG(+):
提示現癥感染或近期感染。
6.間隔2~4周雙份血清抗體亞型轉化/血清抗體水平4倍及以上增加或降低:
確診Mp感染。
評價血清學檢測結果時需要結合患者的臨床病程、基礎狀況以及年齡等因素綜合考慮,如:免疫功能低下、缺陷的人群、產生抗體能力較低的嬰幼兒,可能不產生或產生低滴度的抗體[22,23]。抗體在部分治愈患者體內會持續陽性,期間再次感染的確診應做Mp的抗體滴度或RNA檢測以佐證。
三、藥敏試驗和耐藥基因檢測
因Mp培養條件要求苛刻,生長緩慢,不推薦臨床實驗室常規做體外藥物敏感性試驗。美國臨床與實驗室標準委員會(CLSI)2011年頒布了支原體體外藥敏測定即M43-A指南9,可用于Mp耐藥流行病學調查和分析[24]。指南推薦微量稀釋法測定Mp最低抑菌濃度(minimal inhibitory concentration,MIC),其敏感/耐藥的判斷標準(MIC值):左氧氟沙星≤1 mg/L,莫西沙星、紅霉素及阿奇霉素≤0.5 mg/ L,四環素≤2 mg/L為敏感;紅霉素及阿奇霉素>1 mg/L為耐藥[10],質控菌株為肺炎支原體FH(ATCC15531)。
Mp重癥感染合并多種肺外并發癥且藥物治療不佳的病例報道日漸增多。有研究顯示,23S rRNA結構域Ⅱ區和Ⅴ區基因位點突變可導致抗生素與核糖體親和力下降而引起耐藥,基因突變導致的藥物結合靶點改變是Mp對大環內酯類耐藥的最重要原因[25],結構域Ⅴ區A2063G、A2064G突變導致高水平耐藥,A2067G、C2617G突變發生低水平耐藥[26]。臨床上可以參考Mp 23S rRNA基因突變位點進行耐藥分析[27]。
四、肺炎支原體檢測的質量控制
Mp檢測的質量控制是獲得準確可靠結果的前提,檢驗的質量控制從檢驗前、中、后質量控制三部分闡述。
(一)檢驗前質量控制
檢驗前質量控制主要是樣本采集、運輸、保存過程的質量控制和標準化,應作為重點培訓和規范內容推廣。
病原學檢測標本采集盡可能采集多種類型的標本和(或)連續多個時間點采集不同部位的標本,以滿足最低檢測閾值采集量、陽性率和多種檢測方法聯合檢測的需求。咽、鼻、喉拭子最易獲得,痰液需判斷是否合格,肺泡灌洗液的雜菌污染較少,不同標本的病原學檢測靈敏度和特異性研究報道不一致,40%~80%不等[28,29],晨痰對呼吸道支原體的檢測價值較高,可依據臨床實際情況選擇,具體操作規范見表1。用做核酸檢測的樣本容器不可含核酸酶,以防止核酸降解;容器內應預裝具有防核酸降解功能的保存液,有利于標本保存和轉運。呼吸道標本室溫下30 min內送檢,4 ℃環境下2~4 h內送檢,標本4 ℃保存不應超過48 h,預計延遲送檢的標本應在-70 ℃條件下保存[30]。血液應盡可能采集急性期和至少間隔2周的恢復期雙份血清。


表1 樣本采集、運輸、保存規范表
(二)檢驗中質量控制
檢驗中質量控制主要包括檢測方法的選擇、性能驗證、室內質控、室間質評四方面。
1.檢測方法的選擇:
鑒于Mp獨特的病原學特點、病原學檢測的合格取材問題、血清學檢測的時間窗和機體免疫條件影響以及不同檢測方法的敏感度、特異度的不同,采用一種檢測方法無法達到最終確診,因此病原學與血清學聯合診斷仍然是目前提倡的Mp感染診斷策略[11]。本共識給出分等級推薦的檢測方法,應用時可根據實驗方法學的優劣勢、貢獻度和實驗室能力選擇。
一級推薦方法:Mp病原學采用分子生物學RNA檢測;Mp血清學檢測方法采用顆粒凝集法抗體滴度測定。
二級推薦方法:Mp病原學采用分子生物學DNA檢測;Mp血清學檢測方法采用ELISA抗體分型檢測。
三級推薦方法:Mp病原學采用培養法或直接檢測法;Mp血清學檢測方法采用間接免疫熒光法、免疫膠體金法;非特異性血清學檢測方法。
一級為最佳方法,陽性可確診Mp感染,三級推薦方法中的Mp直接檢測法和GICT對門急診患者Mp感染診斷的快速初篩是有價值的,進一步診斷需一級、二級推薦方法的確認或動態復檢。建議有能力的實驗室開展一級、二級推薦方法,病原學培養法雖不作為常規臨床診斷推薦方法,但其真陽性可確診Mp感染,分離株對進行種屬鑒定、耐藥基因檢測及藥敏實驗具有重要的臨床意義。CLIA因應用不廣泛,暫不列入推薦等級。
目前國內關于Mp檢測的各類試劑盒生產廠家眾多,抗原、抗體選擇不同,方法的敏感度和特異度不同,使判斷結果存在差異,因此實驗室應至少開展兩種及以上不同的檢測方法以彌補相互之不足,并且同一類檢測方法應進行兩種及以上試劑的比對試驗,選取結果更好的作為最終使用試劑。
2.檢測方法的性能驗證:
Mp的實驗室檢測項目均需開展性能驗證,即是檢測結果準確可靠的保證,也是ISO15189對臨床實驗室的要求。血清學項目的檢測應按照定性檢測項目的性能驗證指南進行,分子診斷方法的檢測按照分子生物學檢測方法的性能驗證指南進行。
3.室內質控和室間質評:
按照ISO15189對臨床實驗室的要求,Mp所有檢測項目需要開展室內質控和室間質評。
室內質控物的選擇:陰、陽性質控物為外部對照,用于監控實驗的有效性,實驗室在選擇時應考慮類型(宜選擇人血清基質,避免工程菌或動物源性等的基質)、濃度(弱陽性質控物濃度宜在2~4倍臨界值左右,陰性質控物濃度宜在0.5倍臨界值左右)、穩定性(宜選擇生產者聲明在一定保存條件下2~8 ℃或-20 ℃以下,有效期為6個月以上)、均一性。
室內質控頻率:每檢測日或分析批,應使用弱陽性和陰性質控物進行質控。
室內質控物位置:不能固定而應隨機放置且應覆蓋檢測孔位(標本間隔)。
室內質控評定規則:肉眼判斷:陰性、陽性質控物的檢測結果分別為陰性、陽性即在控;滴度判斷:陰性質控物必須陰性,陽性質控物結果在上下1個滴度內為在控。
判斷規則:根據不同項目可以采用肉眼判斷的規則,也可采用統計學質控規則,至少利用一個偶然誤差及一個系統誤差規則。
室間質評:目前,國家及省市級臨檢中心尚未開展針對Mp項目的室間質評計劃。因此,Mp檢驗項目應采用實驗室間比對的方式進行評價,比對實驗應滿足如下要求:(1)規定比對實驗的選擇原則;(2)樣本數量:至少5份,包括陰性和陽性;(3)頻率:至少每年2次;(4)判定標準:應有≥80%的結果符合要求;(5)結果不一致時,應分析不一致的原因,必要時,采取有效的糾正措施,并定期評價實驗室間比對對其質量的改進作用,保留相應的記錄。
(三)檢驗后質量控制
檢驗后質量控制主要是檢驗結果質量的保證、檢驗結果的報告和發布,一個實驗室具備多種檢驗方法時,要注意報告發出時的邏輯性。當檢測結果不相符時,應查找檢驗前、中的質量問題;排除檢測導致的假陰性和假陽性后,分析如下。
1.雙陽性結果:
血清學檢測結果陽性,分子生物學檢測結果陽性:基本可確診為Mp感染。此類患者,發病時間多超過一周,抗體已經產生,后期進行療效觀察時可采用RNA檢測。
2.單陽性結果:
血清學檢測結果陰性,分子生物學檢測結果陽性:基本可確診為Mp早期感染。其一,發病時間較短,抗體尚未產生;其二,免疫系統發育不完善、免疫功能低下,未產生抗體或抗體滴度較低。抗體效價4倍變化可進一步確證Mp感染。
血清學檢測結果陽性,分子生物學檢測結果陰性:需依據抗體陽性類型和滴度來判斷Mp的現癥或既往感染,多為治療后的既往感染。
3.雙陰性結果:
血清學檢測和分子生物學檢測結果均陰性,Mp感染的可能性很小,需要進一步鑒別診斷時可監測抗體滴度或重新采樣。
五、兒童Mp呼吸道感染實驗室診斷共識的意義
本共識規范了兒童呼吸道Mp感染的實驗室診斷方法的類型、概念和價值,旨在根據患者現癥和既往、門診和住院、篩查和確診等不同的感染情況選擇不同的檢測方法,結合患者臨床癥狀、體征以及胸片等其他輔助檢查,同時對患者年齡、全身狀況、用藥、病程等綜合判斷,為臨床Mp感染的診斷提供合理、經濟、高效的參考建議。經歸納總結形成Mp實驗室診斷流程圖,見圖1。
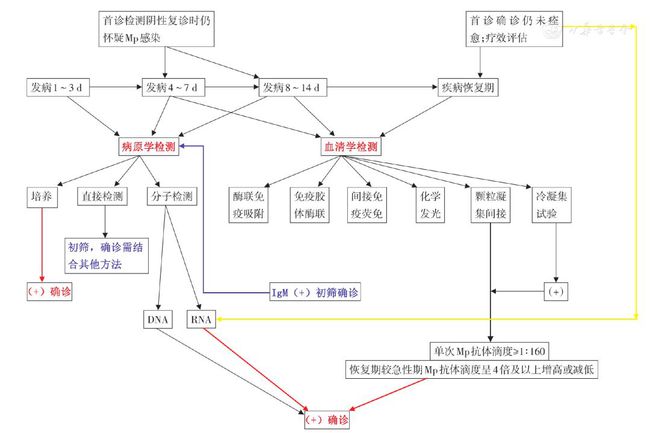
圖1 Mp呼吸道感染實驗室診斷流程圖





