摘要
2016年,在生物科學各領域都收獲了許多重大的研究成果。如今嶄新的2017年已經來臨,那么哪些領域能夠再創輝煌引領潮流?
1.腫瘤免疫療法
腫瘤免疫治療是應用免疫學原理和方法,提高腫瘤細胞的免疫原性和對效應細胞殺傷的敏感性,激發和增強機體抗腫瘤免疫應答,并應用免疫細胞和效應分子輸注宿主體內,協同機體免疫系統殺傷腫瘤、抑制腫瘤生長,是近年來腫瘤治療的一個發展方向,也是當前癌癥研究領域中的熱點之一。
目前免疫治療大致有兩種:
第一種是免疫細胞療法。簡單說就是抽取患者體內的免疫細胞,把腫瘤的特征“告訴”免疫細胞,在體外誘導出可能具有殺傷腫瘤能力的細胞,再輸回患者體內進行“戰斗”。此類療法包括LAK,DC,CIK,DC-CIK,CAR-T,TCR-T,NK,CAR-NK,腫瘤浸潤性淋巴細胞(TILs)等等。但是經過十數年的研究,大浪淘沙始到金,眼下有出色作用的是CAR-T,TCR-T這兩種細胞治療方法。
第二種是免疫檢測點阻斷劑藥物。這些藥物能使癌細胞周圍削弱免疫系統的信號失效,使免疫細胞不被蒙蔽,繼續攻擊腫瘤細胞。如抗體阻斷CTLA-4以及PD-1通路,能阻斷腫瘤細胞對T細胞的“欺騙”,讓T細胞恢復對腫瘤細胞識別和殺傷的能力。
近年來,隨著生物技術的發展,腫瘤免疫療法成為繼腫瘤手術, 放療,化療, 靶向治療后的最有希望能成功治愈癌癥的手段,亮點迭出。最近隨著CAR-T療法成功消滅實體瘤的案例出現,CAR-T療法的研究即將進入了一個令人興奮的新階段。
2017年將會是CAR-T領域不平凡的一年。CAR-T癌癥免疫療法已經準備進入市場,凱特制藥公司(Kite Pharma)和諾華制藥目前正在競爭希望獲得該療法的批準。
而不同免疫療法的聯合應用將是癌癥治療的未來趨勢。2016年12月,腫瘤免疫治療巨頭百時美施貴寶(BMS)公布了腫瘤免疫組合療法Opdivo+Yervoy一項Ib期研究CheckMate-012的更新數據,數據顯示聯合治療組確定的客觀緩解率為43%,是之前已報道的Opdivo單藥組的近2倍。除了免疫檢查點抑制劑的組合療法,腫瘤免疫療法與放療、化療、大小分子靶向療法的聯用也在臨床治療獲得療效。隨著人們對腫瘤生物學和免疫系統研究進一步深入了解,更多的組合方案實踐可能產生更安全有效的臨床效果,真正實現臨床治愈癌癥。
2.基因編輯
基因編輯技術指能夠讓人類對目標基因進行“編輯”,實現對特定DNA片段的敲除、加入等。而CRISPR/Cas9技術自問世以來,就有著其它基因編輯技術無可比擬的優勢,技術不斷改進后,更被認為能夠在活細胞中最有效、最便捷地“編輯”任何基因。
2016年,基因編輯飛速發展,在一系列基因治療的應用領域都展現出極大的應用前景。在這一年里,基因編輯技術也取得了突破性進展,除了CRISPR-Cas,科學家們還開發出了CRISPR/Cpf1、僅靶向RNA的CRISPR/C2c2以及只編輯單個堿基CRISPR/Cas9等新的基因編輯系統。
眼下關于CRISPR專利紛爭風波不斷,同時關于CRISPR-Cas系統的研究也在不斷推進。2015年,通過回輸基因編輯免疫細胞治療白血病的小女孩Layla體內已經檢測不到白血病的跡象。盡管現在這還只是個例,但是到2017年底,基因編輯技術將會拯救許多生命。中國已經開展了CRISPR的首次臨床試驗。而美國即將開展的一項臨床試驗更是雄心勃勃。研究人員打算先給T細胞嵌入一個腫瘤嵌合抗原受體基因,使之可以攻擊腫瘤細胞,然后再用CRISPR敲除PD-1及另外兩個基因。
2017年,美國的法院很有可能會對加利福尼亞大學和博德研究所之間關于CRISPR–Cas9技術的紛爭進行裁決,聲稱發明這項基因編輯技術的研究機構將會從專利許可方面收集數十億美元;與此同時,另外一項很難進行復制的基因編輯技術NgAgo或許會“煙消云散”繼續“游走”在后續深入研究的基礎之上。在英國,很多臨床診所如今都獲得了許可證利用備受爭議的輔助生殖技術將來自三個人的DNA進行混合,這項操作的目的就在于預防兒童患上因母親線粒體而引發的遺傳性疾病。
3.人工基因組合成與再生醫學
人工合成基因組是指在體外人工合成雙鏈DNA分子的技術。
再生醫學是指利用生物學及工程學的理論方法創造丟失或功能損害的組織和器官,使其具備正常組織和器官的機構和功能。
英國《自然》雜志公布的2017年重點關注科學家名單中,基因編輯領域著名人物杰夫·伯克赫然在列。2014年,他成功合成酵母基因組中一條染色體。2017年,伯克如果能夠合成整個酵母基因組,將是科學界首次人工合成一種真核生物的基因組,這將是人造生命體研究向前邁出的一大步。以此為基礎,未來也許可以實現完全的“按需設計”基因,從而創造出最令人滿意的寵物。
2016年,美國25名科學家提出了在10年內合成一條完整人類基因組的計劃——人類基因組編寫計劃(Human Genome Project-Write),曾因倫理問題引發了一些爭議。在他們的計劃中,合成的人類基因組能被用于培育出可移植給人類的異種器官、加速人類對各種疾病疫苗和藥物的研發進程。
在比利時法語布魯塞爾自由大學醫學院再生醫學方向研究員林雄暉看來,再生醫學將是2017年熱點研究方向:比如研究用它治療糖尿病,將患者體細胞變成誘導多功能干細胞,再培育成胰島素分泌細胞移植到患者體內;比如研究用它治療心臟病,先在體外培育心臟細胞,再將其注射或移植到心臟病變部分,取代失活細胞。

4.突破人類胚胎發育時間限制
來自美國和英國的兩個研究小組分別在2016年出版的《自然》和《自然—細胞生物學》雜志上發表論文稱,他們將人類胚胎體外發育的時間提高到10天以上。這兩項研究不僅突破了此前難以超越的7天之限,還將曾經遙不可及的“14天規則”一下拉近到了眼前。問世30余年的人類胚胎研究“14天規則”或因此面臨修訂。
美國洛克菲勒大學胚胎實驗室主任阿里·布萊文盧、英國劍橋大學生理學教授瑪格麗娜·澤尼卡-葛茲帶領各自的研究團隊獨自進行的研究顯示,即使在培養皿中,人類胚胎也能進行細胞分裂和自我發育。培養皿中胚胎經歷的變化與在母體中發育的胚胎并無顯著差異。
人類胚胎發育研究是了解人類早期發育過程,預測遺傳性疾病的一個重要途徑。但此前人類胚胎在培養皿中的發育一直很難超過7天。在新的研究中,通過采用一種過去曾用于培養小鼠胚胎的技術,兩個團隊分別讓這一時間達到了10天和13天,并報告了期間人類胚胎發育的各種事件。這些發現凸顯出小鼠胚胎和人類胚胎之間在細胞類型分化和組織組合方式上的差異。按照國際公認的準則,實驗在胚胎發育的第14天之前終止。
“14天規則”是指科學家只能在不滿14天的胚胎上進行實驗。由于14天之前的人類胚胎還未分化出神經等結構,尚不具備人的特征,因此不涉及倫理問題,這一規則便由此而來。1979年,由當時的美國衛生、教育及福利部倫理咨詢委員會首次提出,而后逐漸被多國監管機構采納,成為國際準則。
《自然》雜志同期發表的評論稱,“14天規則”在過去得到了嚴格的遵守,有很大一部分原因是此前的技術很難突破14天的限制。如今,體外培養胚胎超過14天似乎是完全可行的。與之相關的研究有望把人類對自身早期發育的各方面認識推進到前所未有的精度,應從科學角度出發,邀請專家、政策制定者、患者還有普通民眾參與進來,對規則重新進行評估,對適用范圍等問題作出更為明確的界定。
5.寨卡疫苗測試
寨卡疫苗的效果將在2017年得到驗證。迄今,接受測試的幾乎每一種候選寨卡疫苗都能為猴子提供完全的保護,其中至少有3種疫苗開始了小規模人體試驗,以評估它們的安全性與激發免疫反應的能力。如果這些疫苗通過測試,那么將在明年進行有效性臨床試驗。但有兩個關切可能會延緩疫苗研發進展。一是理論上寨卡病毒抗體可能會與近親登革病毒發生交叉反應,從而讓人們容易感染高致命性的登革熱;二是寨卡疫情在拉丁美洲傳播非常迅速,許多拉美人可能出現了免疫力,這會掩蓋疫苗的效果。

6.人類微生物組
人類微生物組計劃是人類基因組計劃的延伸,它研究的重點是通過基因組學的方法研究人體內(表)的微生物菌群結構變化與人體健康的關系。
科學家們在新的一年里能夠更多地研究人類微生物組影響人類健康的分子機制,人類微生物組是一類病毒、細菌及其它微生物連同其基因在一起的“大集合”;如今研究者檢測了微生物組對人類大腦發育和癌癥發生的影響,同時兩項美國人類微生物組研究計劃也將提供一定的研究結果,這兩項計劃重點對人類微生物菌群同新生兒早產、炎性腸病及2型糖尿病之間的關聯進行研究。

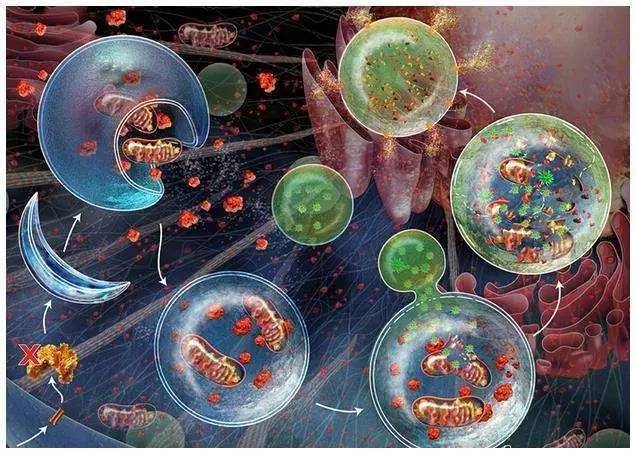
7.細胞自噬
細胞自噬(autophagy)是真核生物中進化保守的對細胞內物質進行周轉的重要過程。該過程中一些損壞的蛋白或細胞器被雙層膜結構的自噬小泡包裹后,送入溶酶體(動物)或液泡(酵母和植物)中進行降解并得以循環利用。
2016年,諾貝爾生理學或醫學獎頒給了日本科學家大禹良典,因其在細胞自噬領域做出的貢獻。
細胞器自噬, 特別是線粒體自噬的分子調控機制目前是線粒體和細胞自噬研究領域同行廣泛關注的焦點問題。自噬相關基因(autophagy associated gene, ATG)是目前研究的另一個熱點。關于自噬, 凋亡和程序性壞死的轉化關系也是近年來研究進展比較多的領域, 三者均參與神經元的死亡過程, 可相互轉換又相互制約。在轉化醫學研究方面,許多調節自噬的藥物被用于臨床腫瘤治療的研究中,如從海洋藥物里發現的稱為”Blue-print autopagy”。
然而,有關自噬相關基因的功能和自噬發生機制還有很多問題有待澄清,如自噬體膜的來源、降解底物的識別以及自噬體與溶酶體的融合機制等。2017年,我們期待在細胞自噬領域看到更多新突破。
8.無創基因篩查
2016年,香港中文大學的盧煜明教授因在無創產前胎兒基因檢查方面的開拓性貢獻獲得了“引文桂冠獎”,并成為未來科學大獎的首屆得獎者。另外,藥明康德集團企業明碼生物科技12月3日發布的無創孕前基因篩查產品——“福碼”(FamilyCODE),可一次性檢測135種亞洲人群中高發的嚴重隱性遺傳病。
2016年10月27日,衛計委發布【45】號重要文件:《關于規范有血開展孕婦外周血胎兒游離DNA產篩查與診斷工作的通知》,廢止此前無創產前篩查與診斷試點機構相關規定,正式取消無創產前篩查與診斷試點,旨在推動落實全面兩孩政策,滿足廣大孕婦對產前篩查與診斷分子遺傳新技術服務的需求。
借著政策的東風,2017年這一技術必將迎來新機遇。

9.人工智能與醫療
若論話題熱度,人工智能無疑是今年最熱話題之一,微軟、谷歌、Facebook、IBM等科技巨頭都競相布局人工智能,除了表面上的營銷噱頭外,更是將其作為其業務競爭力及轉型之需,而對于人工智能在醫療領域的應用價值,業界說法不一,那么,究竟人工智能“插足”醫療領域是雞肋還是正能量?
近年來,人工智能在人類疾病的診療中被越來越多地開發使用,此前,來自美國的科學家就將機器學習和大數據相結合,用于確定攜帶疾病的嚙齒類動物的種類分布,以及容易被新生寄生蟲和病原體傳染的熱點地區。而據國外媒體報道,包括谷歌公司在內的許多公司致力于研究如何延長人類壽命幾十年時間,但美國洛杉磯一家公司提出了一個新概念-使用人工智能技術將人類“起死回生”,而這項技術預計在2040年將實現。
醫療領域人工智能企業Airdoc創始人張大磊認為,人工智能在醫療健康領域的機遇主要有七大方向:臨床診斷輔助系統等醫療服務、機構信息化、醫學影像識別、醫療大數據、藥企研發、健康管理、基因測序等。






