2015年,在國家食品藥品監(jiān)督管理總局的領(lǐng)導(dǎo)下,藥品審評中心(以下簡稱藥審中心)緊緊圍繞“改革審評制度,解決審評積壓,提高審評質(zhì)量,完善審評體系”,不斷推進(jìn)各項(xiàng)工作,切實(shí)維護(hù)和促進(jìn)公眾健康。根據(jù)國家食品藥品監(jiān)督管理總局有關(guān)工作要求,現(xiàn)將《2015年度藥品審評報(bào)告》予以發(fā)布。
一、2015年受理與審評情況
2015年,藥審中心全年接收新注冊申請8211個(gè)(以受理號計(jì),下同)。與既往年度接收注冊申請的比較情況見圖1。
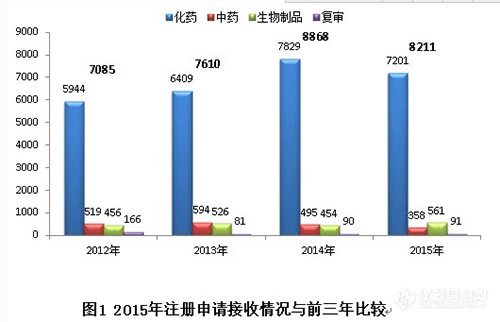
2015年接收注冊申請數(shù)量較2014年有所回落,但仍處于高位。其中化藥和中藥接收量有所下降,生物制品接收量有所增加。近年來,化藥注冊申請的接收量約占各年度接收總量的85%。
2015年,藥審中心全年完成審評的注冊申請共9601個(gè),超過年度接收量1390個(gè),實(shí)現(xiàn)了完成量大于接收量。其中建議批準(zhǔn)臨床4676個(gè),建議批準(zhǔn)上市391個(gè),建議批準(zhǔn)補(bǔ)充申請1183個(gè),建議批準(zhǔn)進(jìn)口再注冊143個(gè),建議各類不批準(zhǔn)2208個(gè),另有企業(yè)撤回等情況的注冊申請1000個(gè)。(超過年度接受量中72%是來自企業(yè)撤回。)
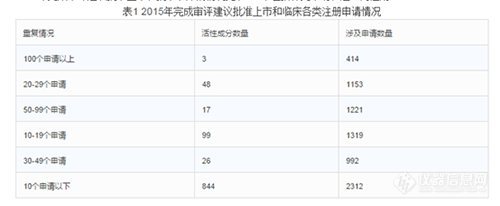
2015年完成審評建議批準(zhǔn)上市和批準(zhǔn)臨床的情況見表1(不包括補(bǔ)充申請和進(jìn)口再注冊)。
(一) 2015年化藥受理和審評情況
1.注冊申請的接收情況
2015年,化藥各序列注冊申請接收情況如下:
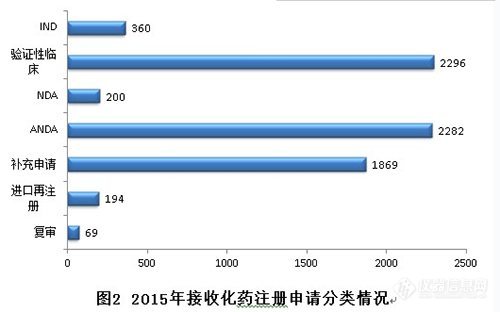
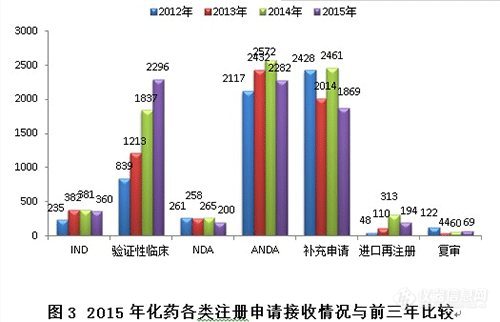
2015年,新接收化藥注冊申請共7270個(gè)。其中驗(yàn)證性臨床、ANDA、補(bǔ)充申請三類注冊申請占化藥全年接收量的88.6%。
與前三年比較,驗(yàn)證性臨床接收量逐年大幅增加,ANDA和補(bǔ)充申請下降較為明顯,具體見圖3。
2.IND各治療領(lǐng)域接收注冊申請情況
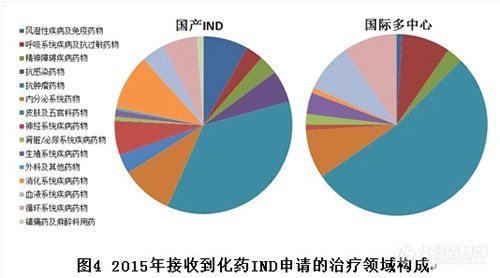
國產(chǎn)IND申報(bào)數(shù)量較多的治療領(lǐng)域有:抗腫瘤藥物、消化系統(tǒng)疾病藥物、內(nèi)分泌系統(tǒng)藥物、風(fēng)濕性疾病及免疫藥物。國際多中心(含進(jìn)口IND)申報(bào)數(shù)量較多的治療領(lǐng)域主要集中在抗腫瘤藥物。(國際多中心抗腫瘤藥物占比目測超過50%,2016年新開的臨床試驗(yàn)大多也是腫瘤藥,各腫瘤醫(yī)院開展臨床熱情與BE試驗(yàn)基地開展情況相比可謂是冰火兩重天)
對比國產(chǎn)和進(jìn)口IND,相同的申報(bào)熱點(diǎn)是抗腫瘤領(lǐng)域,不同的是國內(nèi)IND申報(bào)較多的風(fēng)濕性疾病及免疫藥物、消化系統(tǒng)疾病藥物、神經(jīng)系統(tǒng)藥物、抗感染藥物等領(lǐng)域,幾乎沒有進(jìn)口IND申報(bào)。
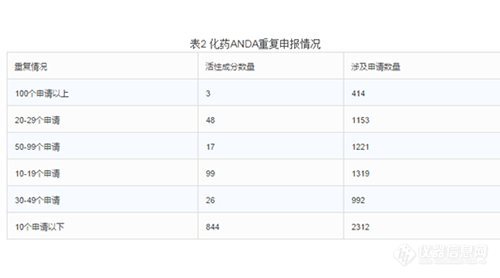
3.仿制藥重復(fù)申報(bào)的情況
截至2015年底,待審的化藥ANDA申請共7411個(gè),占待審任務(wù)總量的42.9%,涉及活性成分1027個(gè)。重復(fù)申報(bào)較嚴(yán)重的有94個(gè)活性成分(待審任務(wù)量均在20個(gè)受理號以上),涉及注冊申請3780個(gè),占化藥ANDA總?cè)蝿?wù)量的51%。其中相同活性成分待審任務(wù)超過100個(gè)的有埃索美拉唑鈉、恩替卡韋、法舒地爾,其中埃索美拉唑鈉和恩替卡韋兩個(gè)活性成分2015年的新申請量仍位列前茅。(埃索美拉唑鈉針劑至今仍沒有一家獲批)。
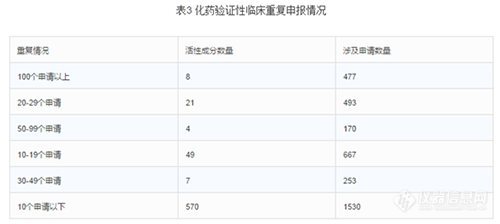
截至2015年底,待審的化藥驗(yàn)證性臨床申請共3590個(gè),占待審任務(wù)總量的20.8%,涉及活性成分660個(gè)。重復(fù)申報(bào)較嚴(yán)重的有40個(gè)活性成分(待審任務(wù)量均在20個(gè)受理號以上),涉及注冊申請1393個(gè),占化藥驗(yàn)證性臨床總?cè)蝿?wù)量的38.8%。其中相同活性成分待審任務(wù)超過50個(gè)的有沃替西汀、阿普斯特、阿考替胺、曲格列汀、阿伐那非、阿法替尼、阿齊沙坦、卡格列凈。(阿齊沙坦片2015年至2016年2月的獲批臨床受理號數(shù)76個(gè),3.1類化藥申報(bào)獲批臨床的制劑第一位)
4.審評完成情況
2015年中心完成化藥審評8514個(gè)(以受理號計(jì)),具體情況見下表。
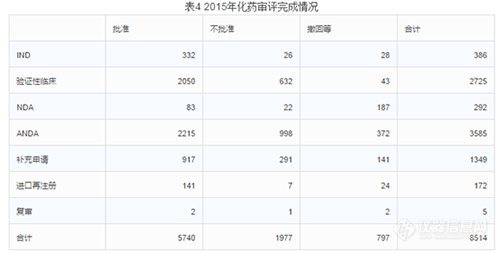
有明確審評結(jié)論的注冊申請中,批準(zhǔn)結(jié)論5740個(gè),不批準(zhǔn)結(jié)論1977個(gè),總體不批準(zhǔn)率為25.6%。(不批準(zhǔn)率最高的是ANDA,不批準(zhǔn)率高達(dá)28%;其次是驗(yàn)證性臨床,不批準(zhǔn)率23%;第三是22%的補(bǔ)充申請。整體撤回率9%,撤回率最高的是NDA,高達(dá)64%;其次是復(fù)審,40%撤回率;第三是進(jìn)口再注冊的14%撤回率。整體批準(zhǔn)率67%,批準(zhǔn)最高的是IND,86%的批準(zhǔn)率;其次是進(jìn)口再注冊,82%;第三是驗(yàn)證性臨床,75%的批準(zhǔn)率。)
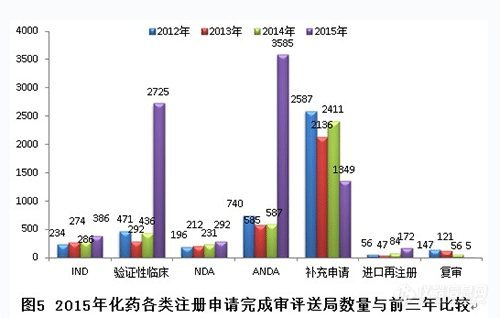
圖5顯示,2105年驗(yàn)證性臨床和ANDA(申請臨床試驗(yàn))兩個(gè)任務(wù)序列完成量大幅增加,IND、NDA和進(jìn)口再注冊兩個(gè)任務(wù)序列的完成量平穩(wěn)增加,補(bǔ)充申請通道完成量下降明顯。
(二) 2015年中藥受理和審評情況
1.注冊申請的接收情況
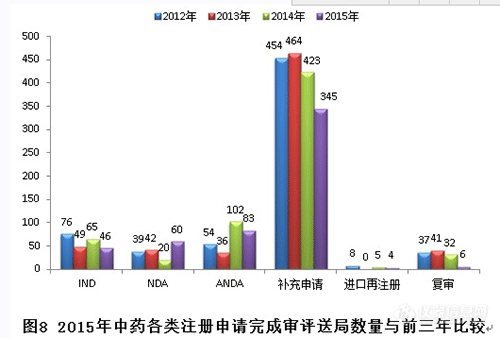
2015年,中藥各序列注冊申請接收情況如下:(補(bǔ)充申請數(shù)量排名第一。)
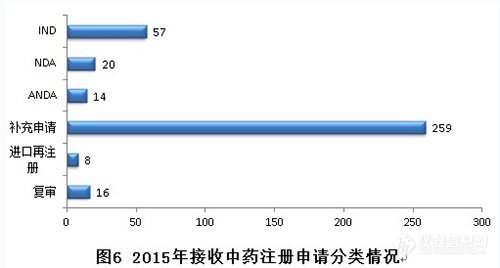
2015年,新接收中藥注冊申請共374個(gè),各類注冊申請接收情況與前三年比較見下圖:
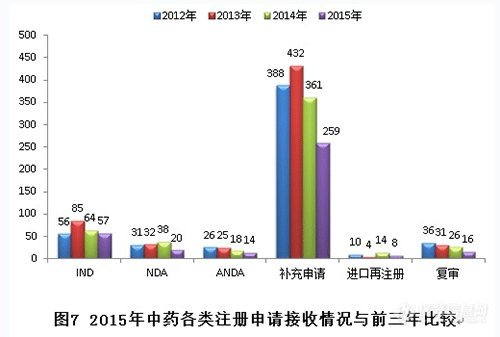
2.審評完成情況
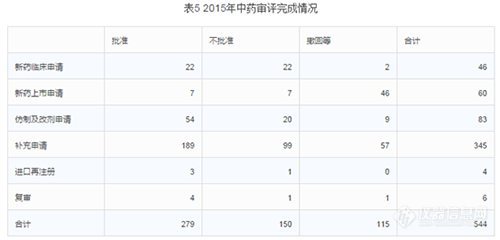
2015年中心完成中藥審評544個(gè),具體情況見下表。其中批準(zhǔn)的仿制及改劑型均為遺留品種。(整體不批準(zhǔn)率28%,不批準(zhǔn)率最高的是新藥臨床申請,不批準(zhǔn)率高達(dá)48%;其次是補(bǔ)充申請,不批準(zhǔn)率29%;第三是25%的進(jìn)口再注冊。整體撤回率21%,撤回率最高的是新藥上市申請,高達(dá)77%;其次是復(fù)審和補(bǔ)充申請,17%撤回率。整體批準(zhǔn)率51%,批準(zhǔn)最高的是進(jìn)口再注冊,75%的批準(zhǔn)率;其次是復(fù)審,67%;第三是仿制及改劑申請,65%的批準(zhǔn)率。)
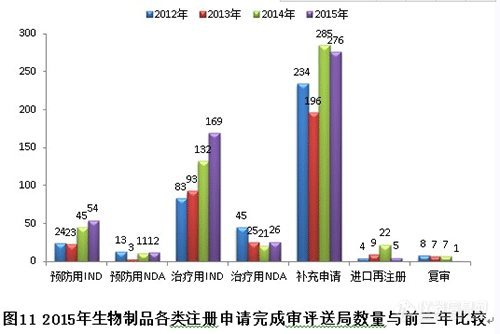
(三)2015年生物制品受理和審評情況
1. 注冊申請的接收情況
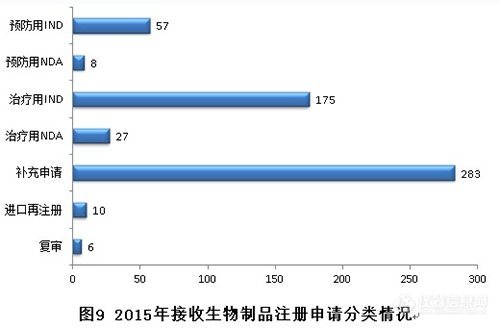
2015年,生物制品各序列注冊申請接收情況如下:(補(bǔ)充申請數(shù)量也是排名第一,治療用IND申請歷史新高。)
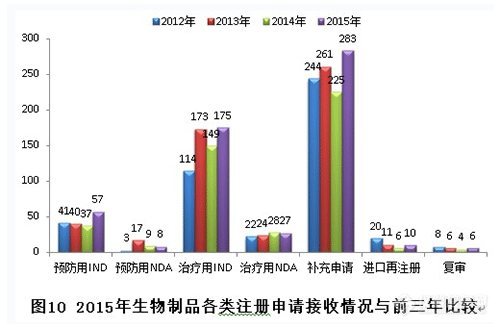
新接收生物制品注冊申請共566個(gè),各類注冊申請接收情況與前三年比較見下圖:
新接收生物制品注冊申請共566個(gè),各類注冊申請接收情況與前三年比較見下圖:
2.審評完成情況
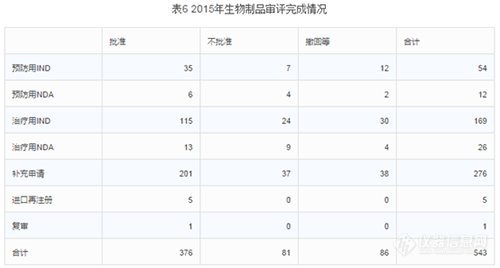
2015年中心完成生物制品審評543個(gè),具體情況見下表。(生物制品完成的審評數(shù)量和中藥基本一直。生物制品整體不批準(zhǔn)率15%,不批準(zhǔn)率最高的是治療用NDA,不批準(zhǔn)率高達(dá)35%;其次是預(yù)防用NDA,不批準(zhǔn)率33%;第三是14%的治療用IND。整體撤回率16%,撤回率最高的是預(yù)防用IND,撤回率22%;其次是治療用IND,18%撤回率;第三是撤回率17%的預(yù)防用NDA。整體批準(zhǔn)率69%,比化藥和中藥的批準(zhǔn)率要高。批準(zhǔn)最高的是進(jìn)口再注冊和復(fù)審,100%的批準(zhǔn)率,數(shù)量也較少,前者5個(gè),后者1個(gè);其次是補(bǔ)充申請,73%的批準(zhǔn)率。)
各類注冊申請完成審評情況與前三年比較見下圖:
二、2015年批準(zhǔn)的重要品種
2015年,藥審中心及時(shí)完成了多個(gè)涉及重大公共衛(wèi)生領(lǐng)域、具有重要社會(huì)價(jià)值品種的審評工作,為患者獲得最新治療手段提供了可能性,也為患者用藥可及性提供了重要保障。
1.Ebola疫苗:我國自主研發(fā)的重組埃博拉疫苗,也是全球首個(gè)2014基因突變型埃博拉疫苗。藥審中心按“特別審評程序”完成了該疫苗臨床試驗(yàn)申請的審評,獲得了世界衛(wèi)生組織(WHO)、西非國家和國際社會(huì)的一致好評。
2.口服I型III型脊髓灰質(zhì)炎減毒活疫苗(人二倍體細(xì)胞):WHO全球消滅脊髓灰質(zhì)炎戰(zhàn)略免疫規(guī)劃推薦的常用疫苗,藥審中心按照“特別審評程序”完成審評并批準(zhǔn)了該疫苗的注冊上市,為實(shí)現(xiàn)WHO全球消滅脊髓灰質(zhì)炎戰(zhàn)略免疫規(guī)劃和相關(guān)疫苗的可獲得性奠定了基礎(chǔ)。
3.腸道病毒71型滅活疫苗: 我國自主研發(fā)的1類新藥疫苗,用于刺激機(jī)體產(chǎn)生抗腸道病毒71型(EV71)的免疫力,預(yù)防EV71感染所致的手足口病。藥審中心按“特殊審評程序”完成了該疫苗審評并經(jīng)總局批準(zhǔn)上市,對有效降低我國兒童手足口病發(fā)病率和重癥死亡率具有重要意義。
4.注射用阿糖苷酶α:目前全球唯一批準(zhǔn)用于龐貝病的藥物。龐貝病是一種進(jìn)行性和致死性代謝性疾病,病情嚴(yán)重,特別是嬰兒型,病情進(jìn)展快,死亡率高,目前國內(nèi)缺乏有效治療手段。該產(chǎn)品按孤兒藥評價(jià)要求及時(shí)完成審評并獲準(zhǔn)在我國進(jìn)口上市,為我國龐貝病患者提供了一種有效的治療藥物。(我國的孤兒藥審評機(jī)制終于有了實(shí)例)
5.門冬氨酸帕瑞肽注射液:目前全球唯一批準(zhǔn)的庫欣氏病對因治療藥物。庫欣病屬于罕見疾病,對于不能手術(shù)或手術(shù)不能治愈的患者數(shù)量更少,且患者常伴多種合并癥,死亡率高,目前國內(nèi)尚無有效的治療藥物。該品種在我國的進(jìn)口上市,為此類患者提供新了的治療手段。
6.醋酸阿比特龍片:全球首個(gè)選擇性、不可逆甾體類抑制劑,屬于全新作用機(jī)制的前列腺癌治療藥物,用于去勢抵抗性轉(zhuǎn)移性前列腺癌(mCRPC)。前列腺癌是男性最常見的惡性腫瘤之一,近年來我國前列腺癌的發(fā)病率呈上升趨勢,一旦化療失敗,缺乏有效的治療手段,同時(shí),還有部分患者不能耐受化療的毒性,因此對該類患者缺乏有效治療手段。該品種在我國上市,將填補(bǔ)現(xiàn)有mCRPC患者治療手段的不足。
7.阿昔替尼片:批準(zhǔn)用于進(jìn)展期腎細(xì)胞癌的成人患者。主要針對既往接受一種酪氨酸激酶抑制劑或細(xì)胞因子治療失敗的進(jìn)展期腎細(xì)胞癌的成人患者,該產(chǎn)品的進(jìn)口上市,將為晚期腎癌患者帶來更多的治療選擇。
8.貝伐珠單抗注射液:批準(zhǔn)用于非小細(xì)胞肺癌的一線治療。相對于單純接受化療治療,以該品種為基礎(chǔ)的一線治療可顯著延長患者的無疾病進(jìn)展生存期。該品種新擴(kuò)展新適應(yīng)癥的批準(zhǔn),為肺癌患者帶來了新的治療手段。
9. 聚乙二醇修飾干擾素:我國第一個(gè)國產(chǎn)上市的聚乙二醇(PEG)修飾干擾素品種,其及時(shí)完成審評并批準(zhǔn)上市,打破了國外進(jìn)口同類產(chǎn)品壟斷中國市場的局面。
10.聚乙二醇化重組人粒細(xì)胞刺激因子注射液:批準(zhǔn)用于非骨髓性癌癥患者在接受易引起臨床上顯著的發(fā)熱性中性粒細(xì)胞減少癥發(fā)生的骨髓抑制性抗癌藥物治療時(shí),降低以發(fā)熱性中性粒細(xì)胞減少癥為表現(xiàn)的感染的發(fā)生率。兩家國內(nèi)企業(yè)獲批該產(chǎn)品上市,可提高患者對該藥物的可獲得性。
11.蒺藜皂苷膠囊:批準(zhǔn)用于中風(fēng)病中經(jīng)絡(luò)(輕中度腦梗死)恢復(fù)期中醫(yī)辨證屬風(fēng)痰瘀阻證者。系針對中醫(yī)藥優(yōu)勢病種開發(fā)的中藥有效部位新藥,將為此類疾病患者增加用藥選擇空間。
(獲批的新藥充分體現(xiàn)了臨床必需用藥優(yōu)先審評審批,且與美國、歐盟盡量同步上市的精神。)





